一、病毒载体介绍
随着国际上抗肿瘤细胞免疫技术的迅猛发展,病毒载体应用于细胞免疫技术治疗肿瘤疾病已经进入了临床应用阶段。然而,关于病毒载体安全性问题仍是困扰目前抗肿瘤细胞免疫治疗的主要问题。作为细胞免疫治疗最理想的载体——病毒载体,具有其他方法无法比拟的优点。其转染效率高,在宿主细胞可以稳定表达以及其表达的抗原更接近于自然。而且可规模化,标准化制备或生产,便于临床使用。目前世界上广泛应用的病毒载体主要是腺病毒、逆转录病毒和腺相关病毒三大病毒载体。其中最安全的是腺相关病毒。
目前已经开发出多种病毒载体,如腺病毒、腺相关病毒、慢病毒、逆转录病毒、疱疹病毒、痘病毒等,它们具有各自的优缺点:
1.腺病毒(Adenovirus,Ad)载体:是研究最早、应用最广泛的病毒载体。其特点是易于制备,可感染多种宿主细胞。缺点是Ad是一种致病性病毒,主要侵犯并导致呼吸系统等病变。而且具有较强的免疫原性,易引起炎症反应和其他不良反应。同时感染宿主细胞后,目的基因表达较短暂,不利于需要持续表达目的基因的免疫治疗。
2.慢病毒(Lentivirus)载体:目前使用的慢病毒载体基本来源于免疫缺陷性病毒(HIV),因此严格上其仍然属于逆转录病毒载体。但其具有感染静止细胞和分裂细胞的特点,可稳定整合到宿主染色体以及持续表达目的基因。其缺点是不仅自身具有较强的免疫原性,不利于免疫细胞治疗,而且插入宿主染色体的不确定性易导致基因突变,并具有潜在感染实验室工作人员的危险。
3.痘病毒和疱疹病毒载体:其特点是可以感染神经细胞。但两者均有着较强的免疫原性,易引起炎症反应和其他不良反应,而且具有潜在的致病性,亦不适合应用于细胞免疫治疗。
4.逆转录病毒(Retrovirus,RV)载体:是一种高效的转导基因的病毒载体,可将目的基因整合到宿主染色体,获得稳定表达。然而具有与慢病毒载体相似的缺点,其具有潜在致瘤性的危险。
二、AAV(adeno-associated virus, AAV)载体介绍
自20世纪60年代被发现以来,腺相关病毒(adeno-associated virus, AAV)载体逐渐成为科学研究与应用的主要基因载体。
腺相关病毒属于细小病毒科,是一种无包膜,大小约为4.7kb,线性单链DNA的非致病性病毒(其基因结构如下图所示)。

AAV是一种缺陷型病毒,其生活史具有两种形式。当宿主细胞存在腺病毒,单纯疱疹病毒或乳头瘤病毒等时,AAV感染细胞,其DNA进入细胞质和细胞核,在腺病毒等辅助病毒帮助下,进行复制并包装成为具有感染性的子代AAV病毒颗粒,释放到胞外,感染其它宿主细胞。但当细胞中不存在腺病毒等辅助病毒,AAV感染细胞后,定向整合于人19号染色体,可进行复制,但不产生或包装成为子代感染性病毒颗粒。通过基因改造,可将重组AAV(Recombinant AAV, rAAV)的整合染色体的特性去除。树突状细胞(DC)及其前体细胞-单核细胞(Monocytes, Mo)是AAV的宿主细胞,但不是腺病毒等辅助病毒的宿主细胞,因此自然状态下DC和Mo都不可能存在这些辅助病毒。携带肿瘤相关抗原基因的rAAV感染DC或Mo后,由于不存在辅助病毒,rAAV仅在细胞中表达肿瘤相关抗原蛋白,并不包装成为具有感染性的子代rAAV病毒颗粒1。

三、AAV(adeno-associated virus, AAV)载体的优势性分析
近日,基因治疗领域专家高光坪教授在Nature reviews Drug Discovery上发表了一篇关于AAV载体的综述,表明了腺相关病毒(adeno-associated virus, AAV)载体作为基因传送疗法载体工具的重要地位,阐述了AAV作为基因疗法传送载体的优势以及应用前景2。
首先,AAV是迄今为止发现的最安全的病毒类基因载体。
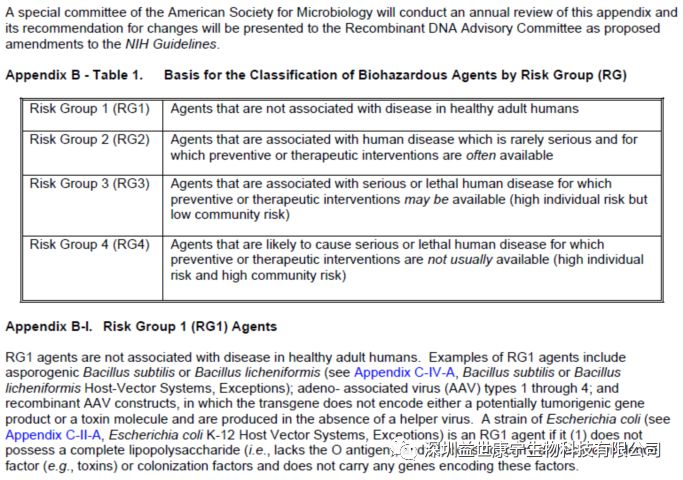
根据美国国立卫生研究院(NIH)生物安全机构和FDA关于生物安全管理的规定。对于用于基因治疗的DNA和基因载体,根据它们对健康成人相对致病性被分成四类(Risk Grades):
风险1类(RG1):生物体与健康成人的疾病无关。
风险2类(RG2):生物体与人类疾病相关。但很少引起严重疾病,且通常可以受到预防或治疗干预。
风险3类(RG3):生物体与人类严重或致死性疾病相关,但可能受到预防或治疗干预。
风险4类(RG4):生物体会引起人类严重或致死性疾病,且通常不受预防或治疗干预。
AAV血清型1至4型、复制缺陷型重组AAV(转基因体既不编码潜在的癌基因,也不产生毒素分子)是目前唯一一种属于RG1类的病毒载体。而既往常用的腺病毒、慢病毒、疱疹病毒、痘病毒均属于RG2类,逆转录病毒属于RG3类。这充分肯定了AAV的安全性。(NIH关于生物安全的原文如下)
经二十余年的全世界广泛研究证明,腺相关病毒(AAV)是一种非致病性病毒,感染人体后,不会导致任何生理改变或病理变化,这已经为医学界所公认。美国国立卫生研究院(NIH)和食品及药品管理局(FDA)连续多年宣布,AAV是用于基因治疗的最安全的病毒载体。
近年来,两项基于AAV的基因疗法获得了官方审批,包括由美国FDA批准的Spark Therapeutics公司开发的Luxturna,用于治疗RPE65突变引起的遗传性失明,以及欧盟药物监管机构批准的Glybera,用于治疗脂蛋白脂酶缺乏症。此外,多项基于AAV的临床试验正在进行中2。这些均说明AAV是学界公认的高安全性的基因载体工具。
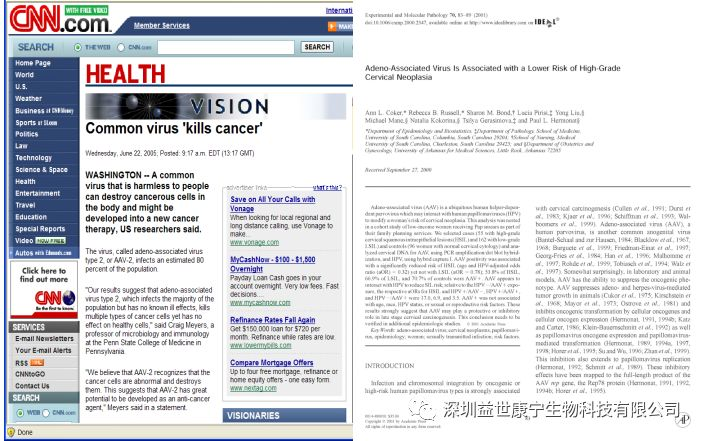
此外,美国阿肯色大学医学院联合美国的其它大学所进行的流行病学调查以及实验室研究表明,AAV不仅无致病性,而且可抑制宫颈癌的发生和发展,抑制人乳头瘤病毒,乙型肝炎病毒以及免疫缺陷性病毒等病毒的复制3。相关报道及已经发表的文献发表如下所示:
另外,作为基因载体,AAV还具有广谱、稳定等多项优点。
AAV在人群中隐性感染率为 60~80%。其具有长期潜伏于人体而不具有任何致病性的优点。不仅AAV感染宿主细胞范围广,可感染分裂细胞和静止细胞,而且稳定性好、便于浓缩、纯化和灭活。此外相对于其它病毒载体,其免疫原性较弱,难以引起机体的免疫反应或炎症反应,有利于反复接种。
四、AAV(adeno-associated virus, AAV)在免疫细胞治疗的应用
目前国内外应用AAV载体的研究日益增多,基于临床治疗的细胞免疫治疗研究就是其中之一。
(一) 免疫细胞治疗现状
树突状细胞(Dendritic cells, DC)是一种专职抗原提呈细胞,具有强大的刺激初始T细胞(naive T cell)增殖以及诱导主要的抗肿瘤免疫反应—细胞免疫反应的功能。DC在细胞免疫应答中发挥着重要作用,是启动机体免疫应答不可或缺的重要环节,具有启动特异性免疫应答和诱导免疫耐受的双重功能。上世纪90年代DC体外培养获得成功,使其逐渐成为免疫学和肿瘤生物治疗研究热点。经过近10年的基础和临床研究,已经充分证明以DC为基础的免疫治疗是一种安全、有效的抗肿瘤治疗方法。
根据美国食品与药品管理局(FDA)公布的信息,截止2011年3月下旬,共受理和批准有关DC的临床试验183项,关于 AAV 基因治疗在研项目8项,表明目前国外在这一领域的研究和临床应用十分活跃。
总之,国内外开展抗肿瘤的细胞免疫治疗及其研究日益增多,取得了令人满意的临床疗效。抗肿瘤细胞免疫治疗逐步列入肿瘤重点专科的评审标准,靶向性抗肿瘤细胞免疫治疗即将迎来新一轮的临床应用和研究高潮。在抗肿瘤治疗中将占据相当重要的地位,成为肿瘤治疗的主流方法之一。
(二) AAV在ACTL靶向性抗肿瘤细胞免疫治疗技术上的应用
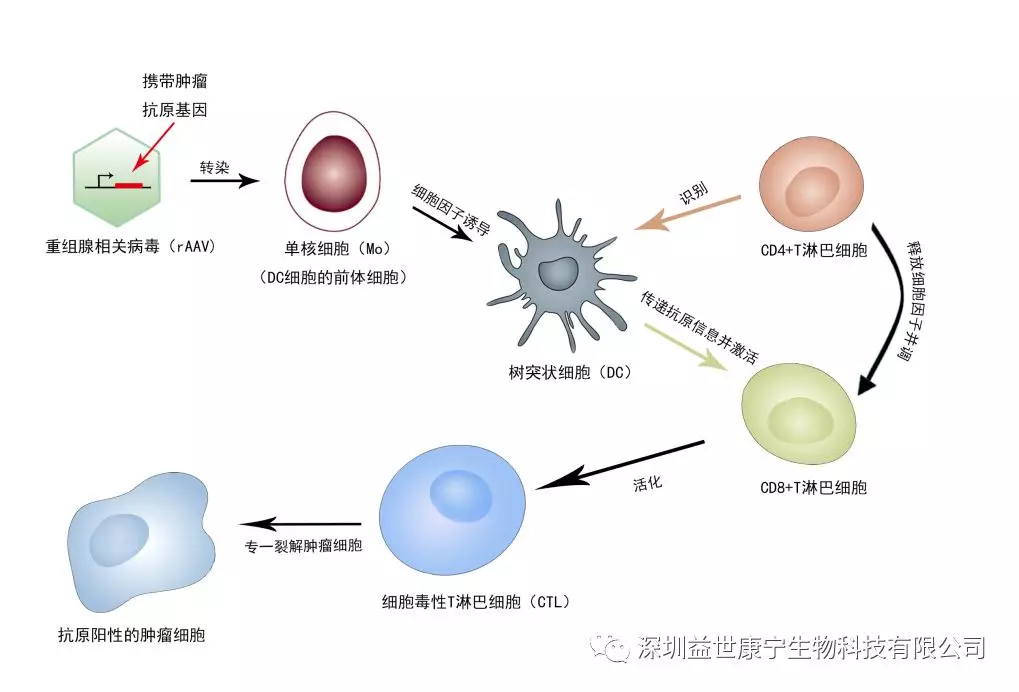
ACTL技术,即以携带肿瘤相关抗原基因的重组腺相关病毒(Recombinant Adeno-associated virus, rAAV)感染树突状细胞(DC)为基础的靶向性免疫治疗,是将腺相关病毒(AAV)改建为携带特定肿瘤相关抗原决定簇基因的重组腺相关病毒(rAAV),感染肿瘤患者的外周血单核细胞来源的DC。经此专利技术获得的 DC 不仅可以刺激产生具有强大的有效杀伤肿瘤细胞的细胞毒性T淋巴细胞(Cytotoxic T lymphocytes, CTL),而且是肿瘤抗原特异性的CTL,具有良好的专一性,即经DC刺激产生的CTL仅针对有 rAAV 所携带的肿瘤抗原阳性的肿瘤细胞具有杀伤作用4-6。对不表达相应抗原的正常组织细胞并无作用,从而避免了许多肿瘤免疫治疗的毒副作用。这是此专利技术的显著特点之一(其特异性杀伤肿瘤细胞的原理见下图)。
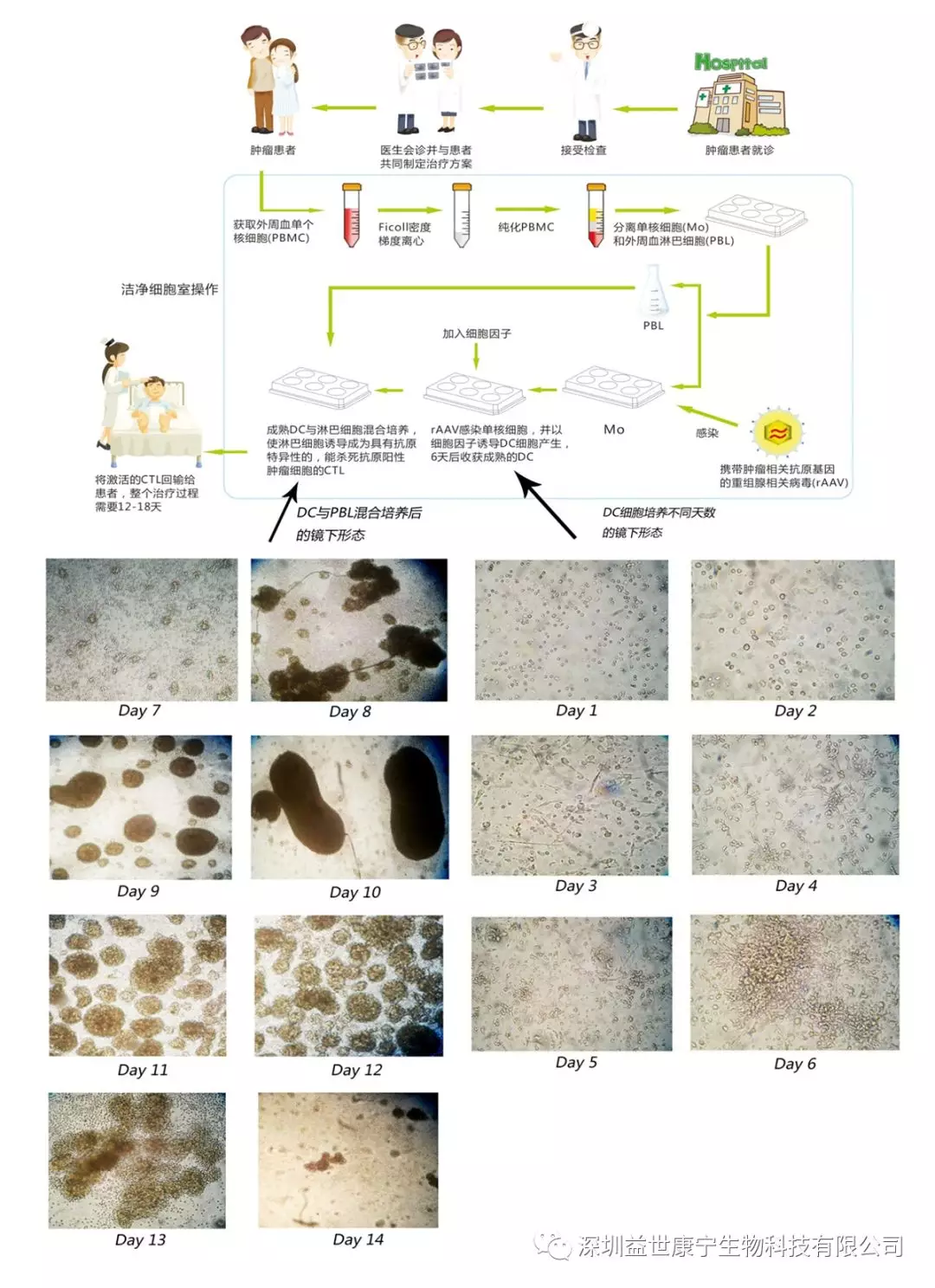
(三) ACTL的技术操作流程
在符合GMP标准的车间生产高纯度、并符合临床应用的高活性和高滴度的携带特定肿瘤相关抗原决定簇基因的rAAV。首先分离患者外周血单个核细胞(PBMC),再进一步分离为淋巴细胞和单核细胞,淋巴细胞继续培养,备用。将rAAV感染单核细胞,并以细胞因子诱导成熟的DC产生。将成熟的DC与淋巴细胞混合培养,诱导淋巴细胞成为MHC-I类分子限制性,并具有杀伤抗原阳性肿瘤细胞作用的CTL,最后将激活的CTL回输给患者。整个过程一般需要 12-18天。
(操作流程图如下)
参考文献
1.Carter, B. J. Adeno-associated virus and the development of adeno-associated virus vectors: a historical perspective. Mol. Ther. 10, 981–989 (2004).
2.Wang D, Tai P W L, Gao G. Adeno-associated virus vector as a platform for gene therapy delivery[J]. Nature Reviews Drug Discovery, 2019: 1.
3. Coker A L, Russell R B, Bond S M, et al. Adeno-associated virus is associated with a lower risk of high-grade cervical neoplasia[J]. Experimental and molecular pathology, 2001, 70(2): 83-89.
4. Liu Y, Santin A D, Mane M, et al. Transduction and utility of the granulocyte-macrophage colony-stimulating factor gene into monocytes and dendritic cells by adeno-associated virus[J]. Journal of Interferon & Cytokine Research, 2000, 20(1): 21-30.
5. Chiriva‐Internati M, Liu Y, Salati E, et al. Efficient generation of cytotoxic T lymphocytes against cervical cancer cells by adeno‐associated virus/human papillomavirus type 16 E7 antigen gene transduction into dendritic cells[J]. European journal of immunology, 2002, 32(1): 30-38.
6. Di L, Zhu Y, Jia J, et al. Clinical safety of induced CTL infusion through recombinant adeno-associated virus-transfected dendritic cell vaccination in Chinese cancer patients[J]. Clinical and Translational Oncology, 2012, 14(9): 675-681.