按照《肿瘤患者筛选标准》确定患者ACTL治疗的适应症后,应根据患者的具体情况,如患者的病情,接受放、化疗情况等,确定其ACTL治疗的具体方案,并掌握如下原则:
1、患者应有血常规、肝肾功能、相关的血清肿瘤标志物(肿瘤抗原或肿瘤相关抗原)化验检测以及影像学检查结果。
2、在ACTL治疗期间,除具有对免疫功能造成损害或者骨髓抑制作用的治疗外,患者可接受其他抗肿瘤治疗。
3、每次治疗回输患者的抗原特异性的细胞毒性T淋巴细胞(cytotoxic T Iymphocytes,CTL)数量应≥1*108
4、对于存在过敏体质或年老体弱的患者,回输CTL时,可考虑给予小剂量的地塞米松。
5、临床治疗级白细胞介素2(IL-2):回输CTL同时,推荐静脉输注IL-2,以调整患者的免疫功能,延长CTL在体内的活性,提高杀伤肿瘤细胞效率。首次回输时,推荐剂量为50万单位,以观察患者对IL-2的耐受性。若患者无明显不良反应或过敏反应,第二次ACTL治疗起,每次回输CTL的同时,给予100-200万单位IL-2。不建议使用我国SFDA批准用于临床治疗的
按照《肿瘤患者筛选标准》确定患者ACTL治疗的适应症后,应根据患者的具体情况,如患者的病情,接受放、化疗情况等,确定其ACTL治疗的具体方案,并掌握如下原则:
1、患者应有血常规、肝肾功能、相关的血清肿瘤标志物(肿瘤抗原或肿瘤相关抗原)化验检测以及影像学检查结果。
2、在ACTL治疗期间,除具有对免疫功能造成损害或者骨髓抑制作用的治疗外,患者可接受其他抗肿瘤治疗。
3、每次治疗回输患者的抗原特异性的细胞毒性T淋巴细胞(cytotoxic T Iymphocytes,CTL)数量应≥1*108
4、对于存在过敏体质或年老体弱的患者,回输CTL时,可考虑给予小剂量的地塞米松。
5、临床治疗级白细胞介素2(IL-2):回输CTL同时,推荐静脉输注IL-2,以调整患者的免疫功能,延长CTL在体内的活性,提高杀伤肿瘤细胞效率。首次回输时,推荐剂量为50万单位,以观察患者对IL-2的耐受性。若患者无明显不良反应或过敏反应,第二次ACTL治疗起,每次回输CTL的同时,给予100-200万单位IL-2。不建议使用我国SFDA批准用于临床治疗的
按照《肿瘤患者筛选标准》确定患者ACTL治疗的适应症后,应根据患者的具体情况,如患者的病情,接受放、化疗情况等,确定其ACTL治疗的具体方案,并掌握如下原则:
1、患者应有血常规、肝肾功能、相关的血清肿瘤标志物(肿瘤抗原或肿瘤相关抗原)化验检测以及影像学检查结果。
2、在ACTL治疗期间,除具有对免疫功能造成损害或者骨髓抑制作用的治疗外,患者可接受其他抗肿瘤治疗。
3、每次治疗回输患者的抗原特异性的细胞毒性T淋巴细胞(cytotoxic T Iymphocytes,CTL)数量应≥1*108
4、对于存在过敏体质或年老体弱的患者,回输CTL时,可考虑给予小剂量的地塞米松。
5、临床治疗级白细胞介素2(IL-2):回输CTL同时,推荐静脉输注IL-2,以调整患者的免疫功能,延长CTL在体内的活性,提高杀伤肿瘤细胞效率。首次回输时,推荐剂量为50万单位,以观察患者对IL-2的耐受性。若患者无明显不良反应或过敏反应,第二次ACTL治疗起,每次回输CTL的同时,给予100-200万单位IL-2。不建议使用我国SFDA批准用于临床治疗的






1、每月一次ACTL科研治疗,六个月为一个疗程;
2、每月检查一次相关的血清肿瘤标志物以及其他项目;
3、二个疗程后,进行全面评估,评估主要指标为相应的血清肿瘤标志物变化情况以及影像学检查结果,如MRI、CT或者PRT-CT等,推荐PET-CT扫描。次要的评估标准为患者的自觉症状;
4、一个疗程后,若患者病情改善或稳定,可进行进行治疗。
1、每月二次ACTL科研治疗,三个月为一个疗程;
2、每月检测一次相关的血清肿瘤标志物以及其他项目;
3、第一个疗程结束后,进行全面评估以决定是否继续进行ACTL科研治疗。
1、放、化疗结束的患者的血白细胞数量恢复或接近正常后,可根据上述治疗方案进行ACTL科研治疗;
2、使用提高白细胞数量的药物促使白细胞数量增加的患者不考虑立即接受ACTL科研治疗。
1、正在接受放、化疗的患者,不推荐同时接受ACTL科研治疗;
2、准备接受放、化疗的患者,可考虑如下ACT科研L治疗方案,但注意发生明显的白细胞数量下降或者骨髓抑制现象后,停止ACTL治疗;
3、以间隔2周的化疗方案为例:在首次化疗前1-2天,开始首次进行ACTL科研治疗的细胞培养阶段。在第二次化疗前的2-3天提取患者外周血细胞后,立即输入首次制备的CTL。以后均按照这种ACTL与化疗交替进行治疗。当发生明显的白细胞数量下降或者骨髓抑制现象后,停止ACTL科研治疗;
1、针对此类患者,采取“冲击”治疗方案;
2、每十天进行一次ACTL科研治疗,每月三次,两个月为一个疗程;
注:抽取第一次患者外周血细胞后,每隔十天提取下一次外周血,按此规律重复进行六次。
3、第一个疗程结束后,进行全面评估,考虑后续治疗方案。
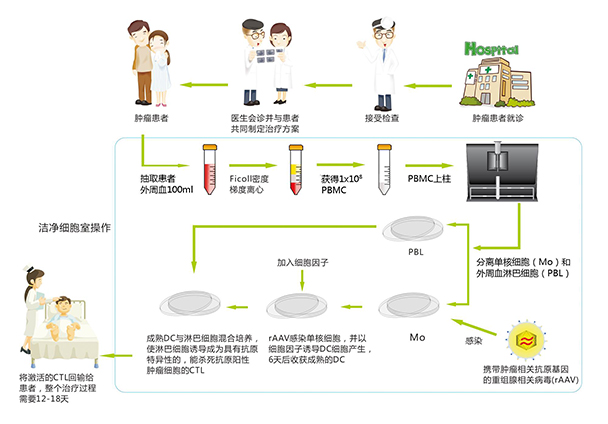
本公司为提高ACTL制备的效率,在第一代ACTL技术的基础上,推出第二代ACTL技术。第二代ACTL技术除具有第一代ACTL技术的所有优点外,其主要特征是快速高效的分离单核细胞和淋巴细胞,不仅收获的DC数量较第一代ACTL技术增加6-8倍,而且纯度更高,相应地增加了具有杀伤作用的CTL数量,CTL纯度更高,更有利于促进ACTL疗效的提高。与第一代ACTL技术相比较,其优点在于:
1.DC制备流程大为简化。操作时间缩短,工作效率增加以及劳动强度降低;
2.分离单核细胞和淋巴细胞的效率明显提高,过程简单,其收获的DC和淋巴细胞的数量和纯度更高,DC的抗原递呈能力更强;
3.CTL制剂的纯度明显增加,明显提高具有杀伤作用的CTL数量,其抗肿瘤的靶向性更强,能更有效的杀灭肿瘤细胞。
简而言之,第二代ACTL的特点是:DC和CTL的数量增加,更加高效和简化,靶向性更强。
本公司研发人员在第二代ACTL的基础上研发成功第三代ACTL技术。第三代ACTL技术除了具有第一和第二代ACTL技术的所有优点外,其主要特点是提高DC和CTL细胞的功能,并产生一定数量的记忆性T淋巴细胞。与第一、二代ACTL技术相比较,其优点在于:
1.制备流程更加简化,提高制备效率;
2.DC的抗原递呈能力和共刺激能力以及CTL的杀伤活性明显提高;
3.产生一定量的记忆性T淋巴细胞,提高对肿瘤转移和复发的疗效。
本公司研发人员在ACTL技术的基础上研发出的第四代ACTL技术,除了具有一、二、三代ACTL技术的所有优点外,其优点在于:
1.rAAV在感染单核细胞后能在数小时内快速表达肿瘤相关抗原蛋白,并达到表达高峰,区别于普通载体需要72小时后才能达到表达高峰;
2.提高肿瘤相关抗原的表达量,更好地刺激DC分化和成熟;
3.有利于缩短DC表达抗原、加工抗原和培养的时间。
本公司研发人员在研发出第四代ACTL技术的同时,研发出第五代ACTL技术。第五代ACTL技术除了具有以往各代ACTL技术的所有优点外,其优点在于:
1.rAAV能够定向感染单核细胞,而对其他细胞无作用,进而更好的保障rAAV的安全性;
2.定向感染有利于提高rAAV的感染率。